Fosforylacja wpływa na wszystkie aspekty życia komórkowego, a kinazy białkowe wpływają na wszystkie aspekty funkcji komunikacji wewnątrzkomórkowej poprzez regulację szlaków sygnałowych i procesów komórkowych. Jednak nieprawidłowa fosforylacja jest również przyczyną wielu chorób; W szczególności zmutowane kinazy białkowe i fosfatazy mogą powodować wiele chorób, a wiele naturalnych toksyn i patogenów również ma wpływ poprzez zmianę stanu fosforylacji białek wewnątrzkomórkowych.
Fosforylacja seryny (Ser), treoniny (THR) i tyrozyny (Tyr) jest odwracalnym procesem modyfikacji białka. Biorą one udział w regulacji wielu aktywności komórkowej, takich jak sygnalizacja receptora, powiązanie i segmentacja białka, aktywacja lub hamowanie funkcji białka, a nawet przeżycie komórek. Fosforany są naładowane ujemnie (dwa ładunki ujemne na grupę fosforanu). Dlatego ich dodatek zmienia właściwości białka, która zwykle jest zmianą konformacyjną, co prowadzi do zmiany struktury białka. Po usunięciu grupy fosforanowej konformacja białka powróci do pierwotnego stanu. Jeśli dwa białka konformacyjne wykazują różne działania, fosforylacja może działać jako przełącznik molekularny białka do kontrolowania jego aktywności.
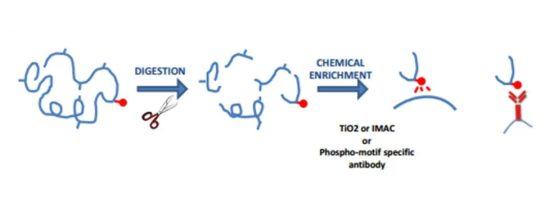
Wiele hormonów reguluje aktywność specyficznych enzymów poprzez zwiększenie stanu fosforylacji reszt seryny (Ser) lub treoniny (THR), a fosforylację tyrozyny (Tyr) można wywołać przez czynniki wzrostu (takie jak insulina). Grupy fosforanowe tych aminokwasów można szybko usunąć. Zatem Ser, Thr i Tyr działa jako przełączniki molekularne w regulacji aktywności komórkowej, takich jak proliferacja guza.
Syntetyczne peptydy odgrywają bardzo przydatną rolę w badaniu substratów i interakcji kinazy białkowej. Istnieją jednak pewne czynniki, które utrudniają lub ograniczają możliwość adaptacji technologii syntezy fosfopeptydów, takie jak niemożność osiągnięcia pełnej automatyzacji syntezy w fazie stałej i brak wygodnego połączenia ze standardowymi platformami analitycznymi.
Technologia syntezy peptydów i modyfikacji fosforylacji na platformie przezwycięża te ograniczenia przy jednoczesnym poprawie wydajności i skalowości syntezy, a platforma jest dobrze nadaje się do badania substratów kinazy białkowej, antygenów, cząsteczek wiążących i inhibitorów.
Czas postu: 2025-07-02
