Modyfikacja fosforylacji odgrywa kluczową rolę w życiu komórek i wpływa na wiele aspektów. Fosforylacja białek jest ściśle związana z różnymi procesami biologicznymi, takimi jak naprawa uszkodzeń DNA, regulacja transkrypcji, transdukcja sygnału i regulacja apoptozy komórkowej. Badanie fosforylowanych białek i peptydów pomaga ujawnić mechanizmy tych procesów i pogłębiać nasze zrozumienie esencji działań życiowych. Biotechnologia peptydowa Hong ma dojrzałą technologię znakowania peptydu fosforylacji. Wykorzystując własne zalety technologiczne i surowca, możemy syntetyzować peptydy zawierające fosforylowaną serynę (PSER), fosforylowaną treoninę (PTR) i fosforylowaną tyrozynę (PTYR) i dostarczać peptydy o wysokiej jakości z jednym do pięciu miejsc fosforylacji.
Przegląd technologii oznaczania fosforylacji:
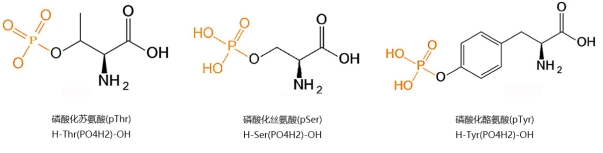
Fosforylowane peptydy odnoszą się głównie do łańcucha hydroksylowego łańcucha seryny (Ser), tyrozyny (TYR) i reszt treoniny (THR) w łańcuchu peptydowym modyfikowanym w kwaśnych estrach fosforanowych. Fosforylowane peptydy odgrywają kluczową rolę w badaniu fosforylacji białka. Dlatego szczególnie ważne jest, aby głęboko zbadać reakcje fosforylacji białek i peptydów oraz znaleźć dojrzałe i proste metody syntetyczne.
Obecnie metody modyfikacji fosforylacji peptydów należą głównie na dwie kategorie:
(1) Bezpośrednio włącz odpowiednio chronione fosforylowane aminokwasy do sekwencji peptydowej:
Po pierwsze, aminokwasy, które muszą być fosforylowane (takie jak Thr, Ser lub Tyr), są poddawane leczeniu fosforylacji i odpowiednio chronione. Następnie, po konwencjonalnym procesie syntezy peptydu w fazie stałej (SPPS), fosforylowane monomery są powiązane z określonymi miejscami polipeptydu. Ta metoda jest prosta w obsłudze i stała się jedną z głównych technik modyfikacji fosforylacji peptydów.
(2) Po zsyntetyzowaniu sekwencji polipeptydowej na żywicy, fosforylowane są grupy hydroksylowe łańcucha bocznego Ser, Tyr lub ThR:
Podczas przeprowadzania modyfikacji fosforylacji, jeśli przyjęto metodę bezpośredniego kondensacji fosforylowanych monomerów do polipeptydu, fosforylowany aminokwas, ze względu na większy łańcuch boczny, powoduje wzrost przeszkód sterycznych, utrudniając kondensację łańcuchem peptydowym. Ponadto wprowadzenie kolejnych aminokwasów stanie się również stosunkowo złożone, szczególnie gdy istnieje wiele miejsc fosforylacji. Proces syntezy będzie niezwykle trudny, a produkt końcowy będzie bardzo złożony, co utrudnia separację, a wydajność jest wyjątkowo niska. Dlatego, gdy istnieje wiele miejsc wymagających fosforylacji w łańcuchu polipeptydowym, można uznać za ukończenie syntezy sekwencji polipeptydowej na żywicy, a następnie fosforyluj grupy hydroksylowe łańcucha bocznego Ser, Tyr lub Thr. Podczas tego procesu najpierw selektywnie usuń łańcuch boczny chroniący grupy aminokwasu, które mają być znakowane. W przypadku Tyr i THR można bezpośrednio zareagować niezabezpieczone aminokwasy ich łańcuchów bocznych. Grupy ochrony łańcucha bocznego można ilościowo usunąć pod warunkiem 1% TFA/DCM. W tej metodzie aktywny pośrednik fosforamidatu benzylowego i tetrazolu może być wygenerowany przez reakcję z tym ostatnim i może być powiązany z grupą hydroksylową. Następnie można przeprowadzić reakcję utleniania w warunkach kwasu nadtlenkowego w celu wytworzenia grupy fosfonylowej, wypełniając fosforylację.
Czas postu: 2025-07-16
