Laŭ la konekta maniero de aminoacido kaj sukero, sukerpeptido povas esti dividita en kvar kategoriojn: O-glikosilado, C a N-glikosilado, roso-sakarigado kaj GPI (glikofosfatidlyinositol) konekto.
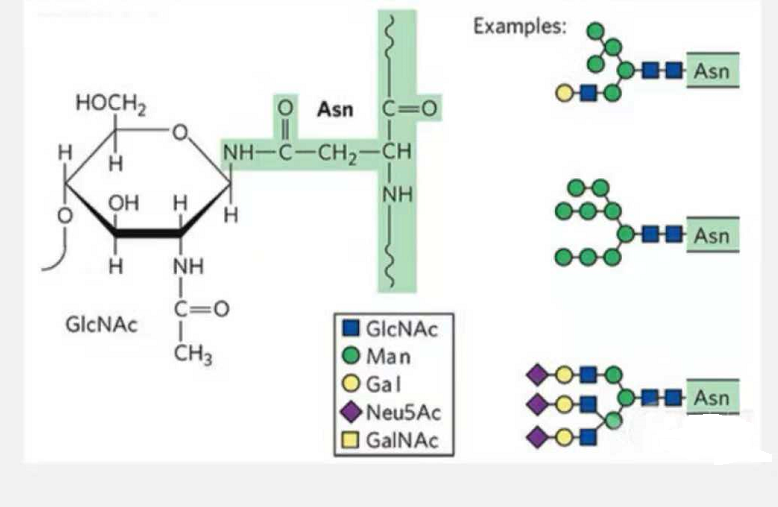
1. N-glikozilaj glikopeptidoj estas kunmetitaj de N-acetamida glukozo ĉe la redukta fino de la glikana ĉeno (Glc-Nac) ligita al la N-atomo sur la amida grupo de la flanka ĉeno de iu Asn en la peptida ĉeno, kaj la Asn. kapabla je ligado de la glikana ĉeno devas troviĝi en la AsN-X-Ser /Thr (X! =P) en la ĉeftemo formita de la restaĵoj.La sukero estas N-acetilglukozamino.
N-glikosilation modifis strukturan glikopeptidon
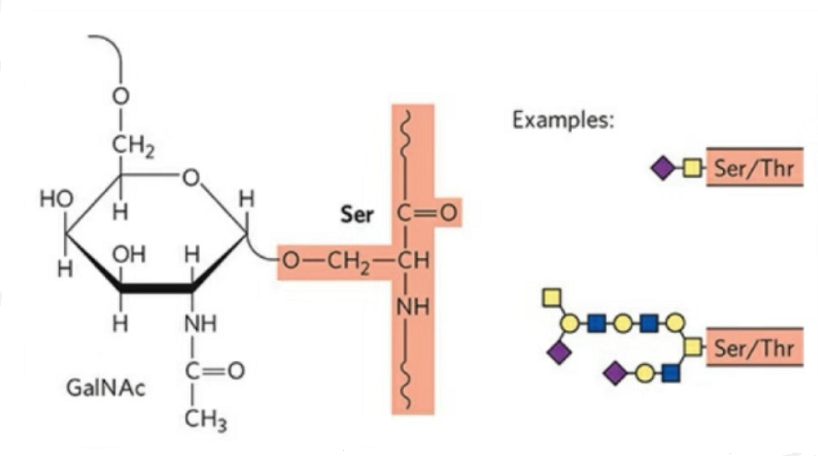
2. La strukturo de O-glikosilado estas pli simpla ol N-glikosilado.Tiu glikopeptido estas ĝenerale pli mallonga ol la glikano, sed havas pli da tipoj ol N-glikosilation.Ser kaj Thr povas ĝenerale esti glikosilateitaj en la peptidĉeno.Krome, ekzistas glikopeptidoj ornamitaj kun tirozino, hidroksilo kaj hidroksiprolina glikosilation.La ligpozicio estas la hidroksila oksigenatomo sur la flankĉeno de la restaĵo.La ligitaj sukeroj estas galaktozo aŭ N-acetilgalaktozamino (Gal&GalNAc) aŭ glukozo/glukozamino (Glc/GlcNAc), manozo/manozamino (Man/ManNAc), ktp.
O-glikosilation modifas la strukturon
3. Glikopeptido O-GlcNAC-glikosilado ((N-acetilcisteino (NAC)) (glcnAcN-acetilglukozamino/acetilglukozamino)
Ununura N-acetilglukozamina (GlcNAc) glikosiligo ligas proteinojn O-GlcNAc al la hidroksila oksigenatomo de la serina aŭ treonina restaĵo de proteino.O-GlcNA-glikosilado estas O-GlcNAc-monosakarida ornamaĵo sen glikana etendo;Kiel peptidfosforiligo, O-GlcNAc-glikosiligo de glikopeptidoj ankaŭ estas dinamika proteina ornamadprocezo.Nenormala O-GlcNAc-ornamado povas kaŭzi diversajn malsanojn kiel ekzemple diabeto, kardiovaskulaj malsanoj, tumoroj, Alzheimer-malsano ktp.
Glikosilaj punktoj de glikopeptidoj
La bazaj strukturoj de polipeptido kaj sukerĉenoj estas ligitaj al proteinĉenoj per kovalentaj ligoj, kaj la ejoj ligantaj la sukerĉenoj estas nomitaj glikosilation ejoj.Ĉar ekzistas neniu ŝablono por sekvi la biosintezon de glikopeptidaj sukerĉenoj, malsamaj sukerĉenoj estos alkroĉitaj al la sama glikosilatejo, kondukante al la tielnomita mikroskopa malhomogeneco.
Glikosilado de glikopeptidoj
1. Efiko de glikopeptida glikosiligo sur terapia-efikeco de terapiaj proteinoj
En la kazo de terapi-terapiaj proteinoj, glikosilation ankaŭ influas la duoniĝotempon kaj celadon de proteinmedikamentoj en vivo.
2. Solvebla glikopeptida glikosilado kaj proteinoj
Studoj montris, ke sukerĉenoj sur la surfaco de proteinoj povas plibonigi la molekula solveblecon de proteinoj
3. Glycopeptide glycosylation kaj proteina imunogeneco
Unuflanke, sukerĉenoj sur la surfaco de proteinoj povas stimuli specifajn imunajn respondojn.Aliflanke, sukerĉenoj povas kovri certajn surfacojn sur la proteinsurfaco kaj redukti ĝian imunogenecon
4. Glycopeptide glycosylation kiu pliigas proteinan stabilecon
Glikosilado povas pliigi la stabilecon de proteinoj al diversaj denaturaj kondiĉoj (kiel denaturantoj, varmego, ktp.) kaj eviti la agregadon de proteinoj.Samtempe, la sukerĉenoj sur la surfaco de proteinoj ankaŭ povas kovri iujn proteolitikajn degenerpunktojn de proteinmolekuloj, tiel pliigante la reziston de proteinoj al proteinazoj.
5. Glycopeptide glycosylation kiu influas la biologian aktivecon de proteinaj molekuloj
Ŝanĝi proteinglikosilation ankaŭ povas ebligi proteinmolekulojn formi novajn biologiajn agadojn
Afiŝtempo: Aŭg-03-2023